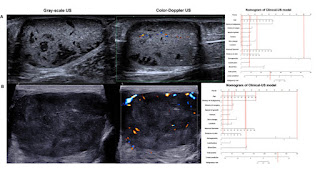
Ultrasonography (US) is the primary imaging method for soft tissue tumors (STTs), the diagnostic performance of which still requires improvement. To achieve an accurate evaluation of STTs, we built the diagnostic nomogram for STTs using the clinical and US features of patients with STTs.
A total of 613 patients with 195 malignant and 418 benign STTs were retrospectively recruited. We used a blend of clinical and ultrasonic features, as well as exclusively US features, to develop two distinct diagnostic models for STTs: the clinical–US model and the US-only model, respectively. The two models were evaluated and compared by measuring their areas under the receiver operating characteristic curve (AUC), calibration, integrated discrimination improvement (IDI) and decision curve analysis. The performance of the clinical–US model was also compared with that of two radiologists.
The clinical–US model had better diagnostic performance than the model based on US imaging features alone (AUCs of the clinical–US and US-only models: 0.95 [0.93–0.97] vs. 0.89 [0.87–0.92], p < 0.001; IDI of the two models: 0.15 ± 0.03, p < 0.001). The clinical–US model was also superior to the two radiologists in diagnosing STTs (AUCs of clinical–US model and two radiologists: 0.95 [0.93–0.97] vs. 0.79 [0.75–0.82] and 0.83 [0.80–0.85], p < 0.001).
The diagnostic model based on clinical and US imaging features had high diagnostic performance in STTs, which could help identify malignant STTs for radiologists.
Giới thiệu
Các khối u mô mềm (STT) là những thực thể lâm sàng khá phổ biến và không đồng nhất. 1 Phân loại bệnh lý và danh pháp rất phức tạp. Tỷ lệ STT ác tính và lành tính được ước tính là gần 1:100. 2 Một số STT ác tính thường bị chẩn đoán nhầm là STT lành tính do có nhiều biểu hiện lâm sàng và hình ảnh trùng lặp, dẫn đến việc quản lý không đầy đủ, chẳng hạn như cắt bỏ ngoài kế hoạch. 3 Để chẩn đoán xác định STT, nên thực hiện sinh thiết trong những trường hợp nghi ngờ. Tuy nhiên, sinh thiết thường quy cho từng thực thể là không thực tế. Do đó, một quy trình tối ưu để chẩn đoán và quản lý STT được coi là một vấn đề thách thức về mặt lâm sàng cần được giải quyết.
Siêu âm là một phương thức hình ảnh có tính sẵn có, tính di động và chi phí thấp đã trở thành một công cụ bổ sung quan trọng cho hình ảnh cơ xương khớp. 4 Bệnh nhân có khối mô mềm được siêu âm để xác nhận chính xác lớp, xác định ranh giới và bờ, đo kích thước, ước tính mạch máu và xác định mối quan hệ giữa khối và mô xung quanh. Với sự phát triển nhanh chóng của công nghệ siêu âm, độ phân giải của siêu âm thang độ xám và khả năng tạo ảnh dòng chảy Doppler màu (CDFI) để mô tả các dị dạng mạch máu đã được cải thiện rất nhiều. Do đó, siêu âm có thể cung cấp thông tin hữu ích hơn để phân biệt các tổn thương ác tính với các tổn thương lành tính và thậm chí cả chẩn đoán bệnh lý của STT, và đã trở thành xét nghiệm đầu tay trong thực hành lâm sàng. 5 , 6 Cho đến nay, đã có nhiều nghiên cứu với mẫu tương đối nhỏ đề cập đến tính chính xác của siêu âm trong việc phân biệt STT lành tính và ác tính. Trong các nghiên cứu trước đây, độ chính xác của siêu âm trong việc nhận biết bệnh ác tính trong STT dao động từ 69% đến 93% bằng cách sử dụng nhiều thông số siêu âm, chẳng hạn như kích thước, rìa khối u, lớp cân và dạng mạch máu. 7–9
Tuy nhiên, trong số nhiều thông số siêu âm có ý nghĩa để xác định bệnh ác tính, có sự không phù hợp về mặt thống kê về giá trị của từng thông số. Vì vậy, rất cần phát triển các mô hình dự đoán để chẩn đoán phân biệt STT lành tính và ác tính bằng cách cân nhắc thống kê sự đóng góp của nhiều thông số siêu âm. Và hơn nữa, không có tiêu chuẩn hoặc mô hình thống nhất nào trong việc phân biệt STT lành tính và ác tính tương tự như Hệ thống dữ liệu và báo cáo hình ảnh tuyến giáp (TI-RADS) hoặc Hệ thống dữ liệu và báo cáo hình ảnh vú (BI-RADS) mà đây là điểm tham chiếu duy nhất trong hệ thống hình ảnh tuyến giáp hoặc vú.
Một toán đồ [nomogram] có thể làm tăng xác suất bằng số của một sự kiện lâm sàng, chẳng hạn như khối u ác tính, bằng cách tạo ra một biểu đồ trực quan của mô hình dự đoán thống kê. 10 Nó đã được chấp nhận như một công cụ đáng tin cậy để định lượng rủi ro bằng cách kết hợp và minh họa các yếu tố quan trọng đối với bệnh ác tính. 10–12 Cho đến nay, toán đồ đã được thiết lập ở phần lớn các loại ung thư. 10–13 Ví dụ, Guo và cộng sự đã phát triển một toán đồ dựa trên siêu âm cải thiện độ chính xác chẩn đoán trong việc xác định các nốt tuyến giáp ác tính; 14 Qiu và cộng sự đã thiết lập và xác nhận một toán đồ để dự đoán khả năng di căn hạch nách như một công cụ trước phẫu thuật để hỗ trợ việc ra quyết định lâm sàng. 15 Theo hiểu biết tốt nhất của chúng tôi, nghiên cứu này là nỗ lực đầu tiên nhằm phát triển và xác nhận một toán đồ dựa trên các thông số siêu âm cũng như các yếu tố nguy cơ lâm sàng để dự đoán STT ác tính.
Khám siêu âm
Tất cả các cuộc kiểm tra siêu âm đều được thực hiện bởi hai bác sĩ X quang cơ xương khớp có kinh nghiệm. Máy siêu âm LOGIQ E9 (GE Healthcare, Milwaukee, WI, USA) với đầu dò lồi C1-6VN (2–6 MHz) và đầu dò tuyến tính ML (6–15 MHz) được sử dụng. Cần có gel siêu âm và áp suất nhẹ lên đầu dò cho vùng tổn thương để tránh khối u bị nén quá mức và tối ưu hóa hiển thị dòng chảy màu.
Tất cả hình ảnh dòng chảy Doppler màu và thang độ xám đều được khảo sát bởi hai bác sĩ X quang có 5 và 10 năm kinh nghiệm về siêu âm cơ xương khớp. Để giảm thiểu sai lệch lựa chọn liên quan đến độ chính xác của chẩn đoán, họ cần đạt được thỏa thuận về các báo cáo của siêu âm. Các đặc điểm sau đây đã được đánh giá và ghi lại: (1) độ vang (liên quan đến cơ: chủ yếu là giảm âm, chủ yếu là đồng âm hoặc chủ yếu là tăng âm); (2) hàm lượng bên trong (chủ yếu là rắn (phần nang 10% thể tích khối), hỗn hợp (phần nang >10% nhưng ≤50%) hoặc chủ yếu là nang (phần nang >50%)); (3) kết cấu tiếng vang (đồng nhất hoặc không đồng nhất); (4) hình dạng (đều, chia thùy hoặc không đều); (5) ranh giới (được xác định rõ: cắt rõ ràng và giống như viên nang mỏng; không xác định: ranh giới không chắc chắn so với mô bình thường lân cận; xác định một phần: trường hợp giữa cả hai bên trên); (6) rìa (mịn: đặc trưng bởi một bề mặt đồng đều, cong dần; gai: thùy, góc cạnh hoặc sự xâm nhập của thành phần rắn của tổn thương vào mô xung quanh ở bất kỳ mức độ nào; thô: đặc trưng bởi bề mặt cong không đều và thô); (7) vị trí (đầu hoặc cổ, thân, chi trên hoặc chi dưới); (8) lớp (lớp cân nông hoặc lớp cân sâu); (9) vôi hóa (không có; vôi hóa vi mô: <0,5 mm; vôi hóa lớn: ≥0,5 mm); (10) mật độ mạch máu (cấp 0, I, II hoặc III); (11) loại mạch máu (vắng mặt, chủ yếu là trung tâm, chủ yếu là ngoại vi hoặc hỗn hợp); và (12) đường kính tối đa. Phân tích phổ và đo độ đàn hồi không được thực hiện thường xuyên.
Độ sâu của tổn thương được đặc trưng là nông hoặc sâu so với fascia được xác định trên siêu âm. Các khối mô mềm bề mặt là những khối nằm ở bề mặt của cân mạc (fascia).16
Các cài đặt cho CDFI như sau: mức thang đo và tần số lặp xung giảm xuống, mức tăng màu được tăng lên cho đến khi nhiễu màu trở nên rõ ràng; Các điều chỉnh giá trị tăng màu và thang tốc độ theo tốc độ dòng máu ở từng tổn thương, để đạt được hiệu quả thị giác tốt nhất mà không bị tràn hoặc gián đoạn tín hiệu dòng máu. Giảm áp lực của đầu dò lên tổn thương để tránh chèn ép các mạch nhỏ, làm cho tín hiệu vận tốc thấp biến mất.
Mật độ mạch máu trên CDFI được phân loại theo phương pháp bán định lượng của Adler và cộng sự như sau: 17 (1) độ 0, không thấy rõ dòng máu trong khối; (2) độ I, chỉ có lưu lượng máu tối thiểu, chẳng hạn như có 1 đến 2 dòng máu có dấu chấm hoặc hình que trong khối; (3) độ II, lượng mạch máu vừa phải, chẳng hạn như dòng máu có 3 đến 4 chấm hoặc một mạch máu quan trọng có thể phát hiện được trong khối; và (4) độ III, có mạch máu rõ rệt, chẳng hạn như có hơn 4 mạch máu hoặc mạch đan xen vào nhau thành mạng lưới.
Sinh thiết
Kim 16-G đã được sử dụng trong sinh thiết do US/CEUS hướng dẫn. Sau khi xác định đầu kim đã nằm trong khối, người thực hiện bóp cò, lấy 3-4 mảnh mô gửi khoa giải phẫu bệnh để kiểm tra.
Khám bệnh lý
Các mẫu được gửi đến khoa giải phẫu bệnh. Sau khi được cố định bằng formalin, nhúng parafin và nhuộm HE, các mẫu này được kiểm tra mô bệnh học định kỳ và một số được làm hóa mô miễn dịch. Tất cả các mẫu vật đã được xem xét theo hướng dẫn ESMO 18 bởi hai nhà nghiên cứu bệnh học là chuyên gia về sarcoma để xác nhận chẩn đoán. Các trường hợp có kết quả sinh thiết không chắc chắn sẽ được đề nghị phẫu thuật.
Phân tích thống kê
Thống kê mô tả được hiển thị dưới dạng trung vị và phạm vi cho các biến liên tục và dưới dạng số lượng người tham gia cho các biến phân loại. Các biến liên tục về tuổi, thời gian mắc bệnh và đường kính tối đa của STT được chuyển thành các biến phân loại dựa trên các giá trị ngưỡng trước khi lập mô hình. Các giá trị ngưỡng được đánh giá bằng cách sử dụng phân tích đặc tính (ROC). Các biến phân loại được so sánh bằng cách sử dụng phép kiểm chi bình phương. Các biến có ý nghĩa trong phân tích đơn biến được đưa vào phân tích đa biến thông qua mô hình hồi quy logistic nhị phân.
Các phân tích thống kê để xác định các yếu tố nguy cơ độc lập đối với bệnh ác tính được thực hiện bằng phần mềm SPSS, phiên bản 23.0 (IBM Corporation, Armonk, NY). Giá trị P <0, 05 được coi là có ý nghĩa thống kê.
Xây dựng toán đồ
Theo kết quả phân tích đa biến, một toán đồ đơn giản về các đặc điểm lâm sàng và siêu âm đã được thiết lập bằng phần mềm R (phiên bản Windows 3.6.1) với gói rms.
Hiệu chuẩn và xác nhận toán đồ
Việc hiệu chỉnh biểu đồ để dự đoán bệnh ác tính được thực hiện bằng cách so sánh xác suất dự đoán với xác suất quan sát được sau khi hiệu chỉnh sai lệch. Hiệu suất của mô hình để dự đoán bệnh ác tính được đánh giá bằng cách tính chỉ số phù hợp (chỉ số C). 19 Chỉ số C càng lớn thì dự đoán càng chính xác. 20 Giá trị của chỉ số C dao động từ 0,5 đến 1,0, trong đó 0,5 thể hiện cơ hội ngẫu nhiên và 1,0 thể hiện khả năng hoàn hảo để phân biệt chính xác kết quả với mô hình.
Sau đó, một đánh giá tổ hợp (validation cohort) được sử dụng để xem có thể áp dụng cho các nghiên cứu khác (external validation, giá trị ngoài nghiên cứu) không. Bootstrap (bộ sưu tập) với 1000 mẫu đã được sử dụng cho các hoạt động này.
Thảo luận
Việc phân loại bệnh lý của STT rất phức tạp và các biểu hiện hình ảnh khác nhau, khiến việc chẩn đoán định tính trở nên đặc biệt khó khăn. Nhiều bác sĩ coi sinh thiết lõi là một thủ thuật đơn giản, ít rủi ro với độ chính xác chẩn đoán từ 80,7% đến 96,9% đối với STT. 21 , 22 Một số chuyên gia thậm chí còn gợi ý rằng nên thực hiện sinh thiết ngay ở những bệnh nhân có nguy cơ ác tính cao. 23 , 24 Tuy nhiên, việc tiến hành xét nghiệm sinh thiết ở từng bệnh nhân là không thực tế và có thể gây biến chứng. Như vậy, làm thế nào để sàng lọc bệnh nhân có nguy cơ cao để sinh thiết bằng phương pháp đơn giản vẫn là vấn đề quan trọng cần được giải quyết.
Siêu âm có độ phân giải tốt với các mô mềm và có thể cung cấp thông tin về kích thước, vị trí và độ sâu của tổn thương cũng như mối quan hệ của tổn thương với các mô xung quanh. Trong những năm gần đây, với việc áp dụng rộng rãi siêu âm trong STT và kinh nghiệm được tích lũy, độ chính xác chẩn đoán của siêu âm trong đánh giá STT đã được cải thiện đáng kể. 8 , 25 Theo hiểu biết tốt nhất của chúng tôi, mặc dù có một số mô hình dự đoán trước đây được báo cáo về STT ác tính theo các phát hiện của siêu âm, nhưng không có toán đồ nào dựa trên các đặc điểm của siêu âm được thiết lập. Vì vậy, trong công việc này, chúng tôi đã phát triển một toán đồ đơn giản và trực quan tích hợp các đặc điểm lâm sàng và siêu âm để dự đoán tỷ lệ ác tính của bệnh nhân mắc STT. Mô hình dự đoán này chứa nhiều trường hợp hơn và ít biến hơn nên đáng tin cậy, dễ thực hiện, có tính khái quát và có độ chính xác tương đối cao. Chúng tôi hy vọng toán đồ có thể đưa ra dự đoán cá nhân về tỷ lệ ác tính, sàng lọc nhiều bệnh nhân ác tính hơn, giảm sinh thiết không cần thiết và giúp bệnh nhân và bác sĩ phẫu thuật đưa ra quyết định tốt hơn trong quá trình chẩn đoán và điều trị lâm sàng.
Training cohort và validation cohort được lấy từ phòng khám siêu âm can thiệp. Những bệnh nhân đến đây khám đa phần là những trường hợp đã được các bác sĩ thảo luận trước tại phòng khám chỉnh hình hoặc phòng khám phẫu thuật tổng quát nhưng lại không có chẩn đoán sơ bộ, điều này thể hiện mức độ phức tạp của ca bệnh. Nếu khả năng ác tính không thể được loại trừ hoàn toàn bởi hai hoặc nhiều bác sĩ X quang có hơn 5 năm kinh nghiệm làm việc tại phòng khám can thiệp siêu âm chúng tôi, thì bệnh nhân được khuyến nghị thực hiện sinh thiết hoặc phẫu thuật và luôn được chuẩn bị tốt tâm lý để trải qua chúng.
chỉ ra rằng mô hình dự đoán trong đó các đặc điểm lâm sàng kết hợp với các thông số siêu âm sẽ hữu ích hơn trong việc xác định mức độ ác tính của STT và hiệu quả chẩn đoán đã được cải thiện bằng cách kết hợp các yếu tố lâm sàng. Vì vậy, chúng tôi đã thiết lập một toán đồ sử dụng các đặc điểm lâm sàng kết hợp với các thông số siêu âm trong nghiên cứu này.
Toán đồ cho thấy các yếu tố nguy cơ độc lập đối với STT ác tính bao gồm mật độ mạch máu, bờ, đường kính tối đa, thời gian mắc bệnh, tuổi và giới tính. Phần lớn các phát hiện này nhìn chung tương tự như các nghiên cứu trước đây, 7 , 25 , 26 báo cáo các yếu tố nguy cơ bao gồm bờ thô, đường kính tối đa, lớp cân sâu, cấu trúc hồi âm không đồng nhất và nhiều mạch máu.
Đáng chú ý, từ toán đố này, chúng ta có thể thấy rằng mật độ mạch máu độ III đóng góp lớn nhất vào dự đoán bệnh ác tính, tiếp theo là ranh giới thô. Nagano và cộng sự 27 nhận thấy rằng khi loại III (tăng mạch máu với nhiều cực ngoại vi) và loại IV (tăng mạch máu với mạch máu bên trong) theo tiêu chí Giovagnorio 28 được lấy làm dấu hiệu ác tính, độ đặc hiệu đạt tới 91,0%. Morii và cộng sự 25 cũng báo cáo rằng tình trạng mạch máu loại III/IV (tiêu chí của Giovagnorio) có liên quan đến nguy cơ cao mắc STT ác tính. Trong nghiên cứu của chúng tôi, mật độ mạch máu độ II/III theo tiêu chí Adler có liên quan đáng kể đến bệnh ác tính. Nagano và Morii đã phân loại lưu lượng máu trong khối u theo tiêu chí của Giovagnorio, trong khi nghiên cứu của chúng tôi áp dụng tiêu chí Adler. Tiêu chí trước bao gồm mật độ mạch máu và loại mạch máu, trong khi tiêu chí sau chỉ bao gồm mật độ mạch máu. Về mật độ mạch máu, loại III/IV theo tiêu chuẩn Giovagnorio tương đương với loại II/III theo tiêu chí Adler.
Về rìa của khối u, chúng tôi đồng ý với Morii và cộng sự 25 và Oebisu và cộng sự, những người cho rằng ranh giới không xác định được của STT được coi là ác tính.
Trong toán đồ này, các STT ác tính cho thấy ưu thế rõ ràng ở nam giới, phù hợp với những phát hiện của De Marchi et al. 26 Đường kính lớn nhất của khối u ≥50 mm là thông số được sử dụng phổ biến cho STT ác tính. 7 , 18 , 29 Kết quả của chúng tôi cũng ủng hộ quan điểm này và thu được giá trị cắt là 58,5 mm.
Thông số lớp cân sâu thường được nhắc đến để dự đoán bệnh ác tính trong STT. 29–31 Các nghiên cứu trước đây như của Datir và cộng sự 32 và Alexander và cộng sự 33 cho thấy tỷ lệ STT ác tính ở lớp cân bề mặt lần lượt chỉ là 19,0% và 3,7%. Tuy nhiên, lớp này không được tích hợp vào biểu đồ này. De Marchi và cộng sự cũng phát hiện ra rằng STT ác tính không có mối tương quan với lớp cân sâu. 29 Để xác định lý do, chúng tôi đã phân tích kết quả bệnh lý cuối cùng của STT lành tính () và nhận thấy rằng trong 5 bệnh phổ biến nhất (như u bao sợi thần kinh, u mỡ, u máu, viêm u hạt và u tế bào khổng lồ của bao gân), 75,5% (37/49) đều ở lớp cân sâu. Vì vậy, dường như có liên quan đến việc lựa chọn mẫu.
Xác thực toán đồ là cần thiết để tránh mô hình bị khớp quá mức và xác định tính khái quát của nó. 34 Các đường cong hiệu chỉnh của nghiên cứu này cho thấy dự đoán của toán đồ phù hợp với quan sát thực tế đối với STT ác tính, điều này cho thấy độ lặp lại và độ tin cậy của toán đồ đã thiết lập. Sự phân biệt đã được nhận ra và dự đoán được hỗ trợ bởi chỉ số C cao đáng kể của toán đồ đã thiết lập trong training cohort (0,89, KTC 95%: 0,85–0,94); trong external validation cohort, khả năng phân biệt giảm nhẹ với chỉ số C là 0,83 (KTC 95%: 0,73–0,94). Chúng tôi suy đoán rằng cỡ mẫu có thể là nguyên nhân chính gây ra sự khác biệt này; một lý do khác có thể là một số loại STT bệnh lý khác nhau đã được đưa vào validation cohort, trong khi những loại đó không được đưa vào training cohort.
Tuy nhiên, có một số hạn chế trong nghiên cứu này. Đầu tiên, tính không đồng nhất của STT là lý do chính và nhiều bệnh nhân có tổn thương lành tính có thể bị bỏ sót vì không sinh thiết lõi hoặc sinh thiết mổ hở. Thứ hai, toán đồ không kết hợp các biến số siêu âm khác, như tốc độ dòng máu, chỉ số sức cản, độ đàn hồi, CEUS, v.v. . Cuối cùng, tiêu chí được báo cáo của nghiên cứu này chỉ đại diện cho mức khu vực và toán đồ chưa được thử nghiệm trên các mẫu từ các khu vực khác, vì vậy cần xác thực và đánh giá thêm hiệu quả. Cần nỗ lực nghiên cứu đa trung tâm, thu thập dữ liệu tiềm năng và theo dõi ở phạm vi rộng hơn và kết hợp nhiều yếu tố lâm sàng và siêu âm thêm nữa trong tương lai.
——
Cohort là gì?
Cohort tạm dịch là tổ hợp, chỉ tập hợp những người có cùng một điểm chung trong cùng cột mốc thời gian quy định. Tổ hợp chung này có thể đến từ năm sinh, phái tính, các xét nghiệm. ...Bất kỳ chỉ số nào cũng có thể gom người dùng thành các tổ hợp.
Nhưng thông thường cohort được chia dựa trên thời gian kxét nghiệm. Vậy ý nghĩa thực tế của cohort là gì? Cohort sẽ cụ thể hơn những nhóm người mô phỏng tiêu chuẩn. Vì chúng ta thường dùng những cột mốc thời gian để phân chia nhóm tổ hợp. Việc theo dõi, nghiên cứu về hành vi của một nhóm người nhất định theo một mốc thời gian nào đó là phân tích cohort. Phương pháp phân tích Cohort này có thể giúp theo dõi được kết quả và so sánh với các nhóm người khác theo thời gian, đánh giá hiệu suất để tìm xem các đối tượng này có phù hợp hay không.
Chính vì vậy, bạn có thể điều chỉnh thông điệp, hoạt động một cách linh hoạt. Kết quả phân tích Cohort giúp bạn nhận ra các vấn đề tiềm tàng. Từ đây, ta sẽ có các dự đoán chính xác hơn.