Đại dịch Coronavirus Disease 2019 (COVID-19) đã trở thành một cuộc khủng hoảng toàn cầu và có sức tàn phá khủng khiếp hơn bất kỳ bệnh nhiễm nào khác trước đây. Nó đã ảnh hưởng đến một tỷ lệ đáng kể dân số toàn cầu cả về thể chất và tinh thần, đồng thời phá hủy các doanh nghiệp và xã hội trên thế giới.
Các bằng chứng hiện tại cho thấy bệnh học miễn dịch có thể là nguyên nhân bệnh sinh COVID-19, bao gồm giảm bạch cầu lympho, tăng bạch cầu trung tính, rối loạn điều hòa bạch cầu đơn nhân và đại thực bào, giảm hoặc chậm đáp ứng với interferon loại I (IFN-I), tăng cường phụ thuộc vào kháng thể và đặc biệt là cơn bão cytokine (CS). CS được đặc trưng bởi sự tăng sản của một loạt các cytokines tiền viêm và có tiên lượng xấu. Các cytokines tiền viêm được tiết ra quá mức này bắt đầu các kênh truyền tín hiệu viêm khác nhau thông qua các thụ thể của chúng trên các tế bào miễn dịch và mô, dẫn đến nhiều triệu chứng phức tạp bao gồm sốt, hội chứng rò rỉ mao mạch, đông máu nội mạch lan tỏa, hội chứng suy hô hấp cấp và suy đa cơ quan, cuối cùng dẫn đến dẫn đến tử vong. Do đó, điều quan trọng về mặt lâm sàng là hiểu các kênh khởi đầu và tín hiệu của CS để phát triển các chiến lược điều trị hiệu quả hơn đối với COVID-19.
Ở đây, chúng tôi bàn luận về những hiểu biết mới nhất về các đặc điểm bệnh lý miễn dịch của COVID-19 và tập trung vào CS, bao gồm cả tình hình nghiên cứu hiện tại của các cytokines khác có liên quan. Chúng tôi cũng nói về cảm ứng, chức năng, tín hiệu xuôi dòng và các biện pháp can thiệp hiện có và tiềm năng để nhắm mục tiêu các cytokines này hoặc các kênh tín hiệu liên quan. Chúng tôi tin rằng sự hiểu biết toàn diện về CS trong COVID-19 sẽ giúp phát triển các chiến lược tốt hơn để kiểm soát hiệu quả bệnh lý miễn dịch trong bệnh COVID-19 này và các bệnh viêm nhiễm khác.
Các nghiên cứu lâm sàng và nghiên cứu cơ bản đã xác định và đặc trưng cho COVID-CS, điều này đã nâng cao hiểu biết về CS và các bệnh lý miễn dịch liên quan trong COVID-19. Một kịch bản đầy đủ về COVID-CS hiện tại có vẻ có quy mô lớn hơn nhiều và chứa nhiều cytokines hơn so với CS được công nhận trong các điều kiện khác, và do đó cũng gây hại nhiều hơn. Mặc dù vẫn chưa rõ bằng cách nào virus biến cấu trúc cytokine bảo vệ thành CS gây viêm, các cytokines dường như được tạo ra chủ yếu bởi các tế bào bẩm sinh vì có ghi nhận về tình trạng giảm bạch cầu lympho. Mặc dù hiện vẫn chưa hiểu rõ hậu quả gây bệnh của từng cytokine với một số thông số miễn dịch ; nhưng rõ là COVID-CS nói chung có liên quan chặt chẽ với những biến đổi gây bệnh chính của COVID-19.
Để điều trị COVID-CS, một số can thiệp sinh
học nhắm mục tiêu cụ thể vào các cytokines gây viêm hoặc các kênh tín hiệu
liên quan đã được đánh giá lâm sàng với kết quả đầy hứa hẹn và nhiều biện pháp
khác đang được triển khai.
Về nguyên tắc, chiến lược
điều trị phải kiểm soát hoạt động hoặc sản xuất cytokine gây viêm đang diễn
ra và tiếp tục cân bằng nội môi của vật chủ. Tuy nhiên, vẫn còn thiếu các loại
thuốc an toàn, hiệu quả để kiểm soát
CS, và trên lâm sàng, việc điều trị CS còn gặp nhiều khó khăn vì một số lý
do:
(1) nhiều y bác sĩ không rõ tình trạng bệnh và hiện đang thiếu các hướng dẫn chẩn đoán và điều trị lâm sàng;
(2) việc nhắm mục tiêu cùng lúc nhiều cytokines là một thách thức đối với dược phẩm. Do đó, điều quan trọng là phải xác định và nhắm mục tiêu các cytokines quan trọng ngược dòng và hệ thống cảm ứng cytokine, hoặc nhắm mục tiêu trực tiếp vào các tế bào sản xuất cytokine chiếm ưu thế như bạch cầu đơn nhân và đại thực bào. Ngoài ra, học hỏi từ hệ thống điều hòa miễn dịch của vật chủ và xác định chống viêm hiệu quả hơn và an toàn hơn các yếu tố / cytokines với tác dụng ức chế phổ rộng là lựa chọn tốt hơn cho can thiệp điều trị; IL-37 đã được đề xuất cho mục đích này;
(3) rất khó
để cân bằng giữa CS và miễn dịch bảo vệ trong các bệnh lây nhiễm, vì mức độ
thích hợp của các cytokines gây viêm có tác dụng bảo vệ chống lại nhiễm trùng và
nếu nhắm mục tiêu không thích hợp các cytokines gây viêm có thể dẫn đến suy giảm
miễn dịch mắc phải và nhiễm trùng tiếp theo;
(4) khác biệt về tuổi tác, tình trạng miễn dịch và các bệnh đi kèm khác giữa các cá nhân dẫn đến sự khác biệt ảo về thành phần và quy mô của CS và điều trị. Do đó, cần phải điều trị chính xác. Lưu ý, việc nhắm mục tiêu lý tưởng vào các cytokines hoặc các kênh phân tử chiếm ưu thế trong tình trạng CS cụ thể nên được tiến hành trước và kịp thời.
COVID-19 đã
dạy cho chúng ta một bài học quan trọng về cách đối phó với những kẻ thù gây bệnh
tự nhiên. Kiến thức và các lựa chọn điều trị được phát triển từ COVID-CS sẽ là
vô giá, không chỉ đối với bệnh này mà còn đối với các tình trạng CS khác.
The Coronavirus Disease 2019 (COVID-19) pandemic has become
a global crisis and is more devastating than any other previous infectious
disease. It has affected a significant proportion of the global population both
physically and mentally, and destroyed businesses and societies. Current evidence
suggested that immunopathology may be responsible for COVID-19 pathogenesis, including
lymphopenia, neutrophilia, dysregulation of monocytes and macrophages, reduced
or delayed type I interferon (IFN-I) response, antibody-dependent enhancement,
and especially, cytokine storm (CS). The CS is characterized by hyperproduction
of an array of pro-inflammatory cytokines and is closely associated with poor
prognosis. These excessively secreted pro-inflammatory cytokines initiate
different inflammatory signaling pathways via their receptors on immune and
tissue cells, resulting in complicated medical symptoms including fever,
capillary leak syndrome, disseminated intravascular coagulation, acute
respiratory distress syndrome, and multi-organ failure, ultimately leading to
death in the most severe cases. Therefore, it is clinically important to understand
the initiation and signaling pathways of CS to develop more effective treatment
strategies for COVID-19. Herein, we discuss the latest developments in the
immunopathological characteristics of COVID-19 and focus on CS including the
current research status of the different cytokines involved. We also discuss
the induction, function, downstream signaling, and existing and potential
interventions for targeting these cytokines or related signal pathways. We
believe that a comprehensive understanding of CS in COVID-19 will help to
develop better strategies to effectively control immunopathology in this
disease and other infectious and inflammatory diseases.
Signal Transduction and Targeted Therapy (2021) 6:255 ;
https://doi.org/10.1038/s41392-021-00679-0

Hình 1 Biểu hiện lâm sàng toàn thân của COVID-19.
SARS-CoV-2 lây
nhiễm các tế bào biểu mô đường thở hoặc các tế bào miễn dịch thông qua liên kết
với thụ thể ACE2, gây tổn thương mô và giải phóng DAMP, cũng như sản xuất
các cytokine gây viêm bởi các tế bào biểu mô và tế bào
miễn dịch. Sau đó, giao tiếp chéo [crosstalk] giữa
các tế bào biểu mô và các tế bào miễn dịch dẫn đến một loạt các
biểu hiện lâm sàng, từ các dạng nhẹ (ví dụ, sốt, ho và đau cơ);
đến các hình thức vừa phải cần nhập viện (viêm phổi và viêm khu trú); đến các
dạng nặng hơn /
nghiêm trọng với tử vong dưới dạng viêm phổi,
ARDS, DIC, CS và suy đa cơ quan.
DAMP danger- associated molecular pattern, dạng
phân tử nguy hại
ARDS acute respiratory
distress syndrome, hội chứng suy hô hấp cấp
DIC disseminated
intravascular coagulation, đông máu nội mạch lan tỏa
Hình 2 Các bệnh lý miễn dịch quan trọng của COVID-19 nặng. Các biểu hiện bệnh lý miễn dịch của COVID-19 bao gồm giảm bạch cầu lympho, rối loạn điều hòa bạch cầu đơn nhân và đại thực bào, bạch cầu trung tính, ADE, giảm hoặc chậm đáp ứng IFN-I và CS. Giảm bạch cầu lympho thường quan sát thấy trong COVID-19 nghiêm trọng. Ngoài số lượng giảm, tế bào lympho thường biểu hiện kiểu hình kiệt sức với biểu hiện mức cao hơn của các dấu hiệu cạn kiệt PD-1, Tim-3 hoặc NKG2A. Tế bào đơn nhân ngoại vi biểu hiện sự thay đổi kiểu hình từ CD16 + sang CD14 + và BALF đại thực bào được gia tăng với quá trình chuyển đổi máu thành BALF. Số lượng bạch cầu trung tính tăng lên khi có sự hiện diện của bạch cầu trung tính tiền chất trong máu ngoại vi, đặc biệt ở những bệnh nhân bị COVID-19 nặng. Sự tồn tại có thể có của ADE giúp tăng cường sự xâm nhập của SARS-CoV-2 vào tế bào thông qua sự tương tác giữa các vùng Fc và các thụ thể Fc, dẫn đến sự trầm trọng thêm của COVID-19. CS được đặc trưng bởi nồng độ chất trung gian gây viêm tăng cao và là đặc điểm đặc biệt quan trọng đối với kết quả kém ở bệnh nhân nặng hoặc nhiễm trùng nguy kịch. Đáp ứng IFN-I giảm hoặc chậm làm cản trở sự thanh thải của virus và gây ra quá trình viêm siêu vi nghịch lý, do đó dẫn đến tiên lượng xấu đi ở bệnh nhân COVID-19.
BALF bronchoalveolar lavage fluid, dịch rửa phế quản phế nang
ADE antibody-dependent enhancement, tăng cường kháng thể phụ thuộc
Hình 3 Các kênh tín hiệu cho sự sản sinh và chức năng của
IFN-I sau khi nhiễm SARS-CoV-2. Sau khi lây nhiễm, các ssRNA của bộ gen và các chất
trung gian dsRNA nhân bản của SARS-CoV-2 được nhận biết bởi các thụ thể giống
như thụ thể nội bào TLR3, 7, 8 và cảm biến RNA tế bào, RIG-1 /MDA5; tiếp theo,
các yếu tố phiên mã xuôi dòng bao gồm NF-κB và IRF3 / 7 được kích hoạt để tạo
ra tiền viêm cytokine và IFN-I. IFN-I có thể kích hoạt kênh JAK1 /
TYK2 – STAT1 / 2, thúc đẩy sự hình thành phức hợp STAT1 / 2 / IRF9 và bắt đầu sự phiên
mã của ISG để tạo ra các chất trung gian chống vi-rút và nó cũng có thể kích
hoạt các kênh gây
viêm như NF-κB bất thường và các kênh MAPK để
gây ra biểu hiện của các cytokine tiền viêm và quá trình viêm siêu vi nghịch lý
trong COVID-19.
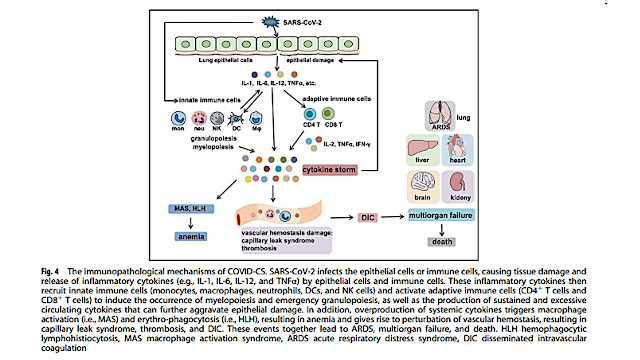
Hình 4 Các cơ chế bệnh lý miễn dịch của COVID-CS. SARS-CoV-2 lây nhiễm vào tế bào biểu mô hoặc tế bào miễn dịch, gây tổn thương mô và giải phóng các cytokine gây viêm (ví dụ, IL-1, IL-6, IL-12 và TNFα) bởi các tế bào biểu mô và tế bào miễn dịch. Các cytokine gây viêm này sau đó tuyển dụng các tế bào miễn dịch bẩm sinh (bạch cầu đơn nhân, đại thực bào, bạch cầu trung tính, DC và tế bào NK) và kích hoạt các tế bào miễn dịch thích ứng (tế bào T CD4 + và tế bào T CD8 +) để gây ra sự xuất hiện của quá trình tạo tủy và tạo hạt khẩn cấp, cũng như sản xuất bền vững và quá mức các cytokine lưu hành có thể làm trầm trọng thêm tổn thương biểu mô. Ngoài ra, sản xuất quá mức các cytokine toàn thân sẽ kích hoạt hội chứng đại thực bào (MAS) và hội chứng thực bào máu (HLH), dẫn đến thiếu máu và làm rối loạn quá trình cầm máu, dẫn đến hội chứng rò rỉ mao mạch, huyết khối và DIC. Những sự kiện này cùng dẫn đến ARDS, suy đa cơ quan và tử vong.
HLH hemophagocytic lymphohistiocytosis, hội chứng thực bào máu,
MAS macrophage activation syndrome hội chứng kích hoạt đại thực bào,
Hình 5 Thác [các tầng] tín hiệu viêm được kích hoạt trong COVID-CS.
SARS-CoV-2 xâm nhập vào tế bào vật chủ và được cảm nhận bởi các thụ thể giống Toll (TLR)
3, 7, số 8;
RIG-I-like receptor, RIG-I hoặc MDA5; và thụ thể giống NOD, NLRP3, cũng có thể
được kích hoạt trực tiếp bởi các protein virus hoặc ROS do tế bào chết theo chương trình [apoptotic] hoặc bị
viêm. Các yếu tố phiên mã xuôi dòng IRF3 / 7 được kích hoạt để tạo ra IFN-I và
liên quan chứng
siêu viêm nghịch lý [paradoxical hyperinflammation]; NF-κB
được kích hoạt để tạo ra các cytokine gây viêm; và NLRP3 viêm nhiễm được kích
hoạt để tạo ra IL-1β và IL-18 trưởng thành. Các cytokine chống viêm như IL-6,
IL-2, TNF-α, và IFN-γ lần lượt kích hoạt tín hiệu JAK-STAT hoặc NF-κB thông qua liên
kết với các thụ thể của chúng được biểu hiện trên các tế bào miễn dịch để tạo
ra nhiều gen tiền viêm [pro-inflammatory
genes], hình thành phản
hồi tích cực để kích hoạt ngưỡng CS. Ngược lại, các cytokine điều hòa như IL-10
được sản xuất bù trừ để chống lại sự tăng động miễn dịch [immune hyperactivity].
Hình 6 Các chất ức chế và liệu pháp tiềm năng để chống lại COVID-CS. Một loạt các chất ức chế hoặc thuốc đã được áp dụng hoặc đang xem xét điều trị COVID-CS, bao gồm cả những thuốc nhắm vào một cytokine gây viêm đơn lẻ hoặc thụ thể của nó và kênh tín hiệu liên quan. Ngoài ra, có thể có một số phương pháp điều trị như immunoglobulin tiêm tĩnh mạch, corticosteroid, y học cổ truyền Trung Quốc và chất ức chế CDK7 khả năng chống lại nhiều cytokine và các kênh liên quan đến COVID-CS.
CDK7 kinase 7 phụ thuộc cyclin
CONCLUSIONS
Clinical and basic research studies have identified and
characterized COVID-CS, which has greatly enhanced our understanding of CS and
related immunopathology in COVID-19. A full scenario of COVID-CS is now
emerging, and it appears to be much larger in scale and contains more cytokines
than the CS recognized in other conditions, and is therefore also more
damaging. Although it is still unclear how the virus turns the protective
cytokine profile into an inflammatory CS, the cytokines appear to be produced predominantly
by innate cells because the lymphopenia was frequently reported in this
condition. While the causative efficacy of individual cytokines on the
development of certain immunopathogenic parameters in this condition is yet to
be fully understood; it is obvious that COVID-CS as a whole is closely associated
with the major pathogenic changes of COVID-19.
To treat COVID-CS, several biologic interventions
specifically targeting inflammatory cytokines or related signaling pathways
have been clinically evaluated with promising results and many others are in
the pipeline.
In principle, the treatment strategy should be to control ongoing
inflammatory cytokine production or activity and resume the host’s homeostasis.
However, we still lack safe and effective drugs to control the CS, and clinically,
the treatment of CS has been proved difficult for several reasons: (1) many
medical doctors are not aware of the condition and hence, clinical diagnosis
and treatment guidelines are currently lacking; (2) it is a pharmaceutical
challenge to simultaneously target multiple cytokines. It is therefore
important to identify and target the key cytokines upstream and the cytokine
induction network, or directly target the predominant cytokine-producing cells
such as monocytes and macrophages. Alternatively, learning from the host
immunoregulatory system and identifying more effective and safer anti-inflammatory
factor/cytokines with a wide-spectrum inhibitory effect may provide a better
option for therapeutic intervention; IL-37 has been suggested for this purpose;381–384
(3) it is difficult to balance CS and protective immunity in infectious
diseases, as the appropriate level of inflammatory cytokines is protective
against infections and inappropriately targeting inflammatory cytokines may
lead to acquired immunodeficiency and subsequent infections; (4) differences
among individuals with respect to age,immune status, and other comorbidities
may result in virtual differences in the component and scale of the CS and
treatment.
Therefore, precise treatment is required. Of note, ideally
targeting predominant cytokines or molecular pathways in a particular CS condition
should be conducted first and in a timely manner.





Không có nhận xét nào :
Đăng nhận xét